
 暂无数据
暂无数据国内适应症:
美国适应症:
 药品简介:
药品简介:
欧狄沃(纳武利尤单抗注射液,又称O药)是是我国首个获批上市的免疫治疗药物,它是一种PD-1免疫检查点抑制剂,独特地利用人体自身的免疫系统来帮助机体恢复抗肿瘤免疫反应。这种通过利用人体自身免疫系统来抗击癌症的特性,使纳武利尤单抗注射液已成为多种肿瘤的重要治疗选择。
慈善赠药:(患者援助)年度3+3,后续3+X,患者年自付费用为人民币110,652元,在申请年度内最多自付6次欧狄沃的治疗费用,便可获得该申请年度内剩余的所有药品援助 详细信息
 科普答疑
科普答疑 上市信息
上市信息


国内上市 二线治疗 欧狄沃(纳武利尤单抗)中国上市 开启肺癌肿瘤免疫治疗时代


国外上市 新辅助治疗 美国FDA批准欧狄沃联合化疗用于特定可切除非小细胞肺癌成人患者新辅助治疗

国外上市 一线治疗 一线治疗非小细胞肺癌!纳武利尤单抗 + 伊匹木单抗联合化疗获美国FDA批准

国内上市 新辅助治疗 肺癌治疗“新”起点!欧狄沃(纳武利尤单抗)获批中国首个且唯一肺癌新辅助适应症


国外上市 一线治疗 一线胃癌首个免疫疗法:Opdivo( 纳武利尤单抗,O药)获FDA批准

国外上市 一线治疗 胃癌食管癌一线免疫治疗!Opdivo(欧狄沃)在日本获批

国内上市 一线治疗 纳武利尤单抗晚期胃癌一线适应症正式上市


国外上市 二线治疗 纳武利尤单抗(O药)获欧盟批准用于二线食管癌免疫治疗


国外上市 一线治疗 胃癌食管癌一线免疫治疗!Opdivo(欧狄沃)在日本获批

国内上市 一线治疗 辅助治疗 欧狄沃(纳武利尤单抗 ,O药)获批两大食管癌适应症辅助治疗,率先实现上消化道肿



国内上市 辅助治疗 国内首个!纳武利尤单抗在华获批尿路上皮癌辅助治疗


国外上市 一线治疗 FDA批准纳武利尤单抗联合卡博替尼治疗晚期肾细胞癌患者

国内上市 二线治疗 纳武利尤单抗(O药)获批成为中国首个治疗头颈部鳞癌的免疫肿瘤药物

国外上市 二线治疗 美国FDA批准纳武利尤单抗治疗头颈部癌


国内上市 二线治疗 PD-1单抗欧狄沃(O药, 纳武利尤单抗)在中国获批二线治疗头颈部鳞癌

国外上市 一线治疗 纳武利尤单抗单药或联合伊匹木单抗获FDA批准用于转移性黑色素瘤的一线治疗



国外上市 二线治疗 重磅!纳武利尤单抗联合伊匹木单抗获FDA优先审评!治疗晚期肝癌!



国内上市 一线治疗 免疫双子星(欧狄沃,O药联合逸沃,伊匹木单抗)国内批准恶性胸膜间皮瘤一线治

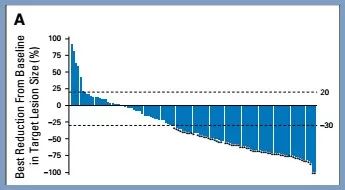
国外上市 二线治疗 纳武利尤单抗+伊匹木单抗在FDA获批结直肠癌适应症


 最新研究
最新研究













辅助治疗 新辅助治疗 肺癌围术期研究CheckMate-77T报捷,欧狄沃用于可切除肺癌再证疗效

新辅助治疗 生存期 O 药新辅助治疗,80% 的肺癌患者术后活过了 5 年





































共纳入1581例未经治疗的PD-L1阳性晚期食管、胃及胃食管癌交界处癌患者。所有患者按1:1的比例分组,分别接受纳武单抗+FOLFOX/XELOX方案治疗,及FOLFOX/XELOX方案治疗。所有患者中,约60%患者的PD-L1 CPS为5或以上。 其结果显示,在超过12个月的随访中,在PD-L1 CPS≥5的患者中,接受纳武单抗+化疗方案治疗的患者(473例)中位总生存期14.4个月,中位无进展生存期7.7个月;接受化疗的患者(482例)中位总生存期11.1个月,中位无进展生存期6.1个月。 在PD 进入专栏

共纳入1581例未经治疗的PD-L1阳性晚期食管、胃及胃食管癌交界处癌患者。所有患者 ... 更多
Ⅲ期
新辅助治疗
双盲
多中心
CheckMate -274是一项随机、双盲、多中心III期临床研究,旨在评估欧狄沃对比安慰剂用于根治手术后高复发风险肌层浸润性尿路上皮癌患者的疗效与安全性。患者无论术前有无接受过新辅助治疗均可入组。共709名患者按1:1比例进行随机分组,分别接受至多一年的每两周240mg?欧狄沃或安慰剂治疗。在所有随机人群中,接受欧狄沃的治疗组中位DFS[21.0个月]与安慰剂对照组中位DFS [10.9个月]相比延长近一倍;风险降低30%。在PD-L1表达≥1%的患者中,欧狄沃将疾病复发或死亡风险降低47%,欧狄沃治 进入专栏

Ⅲ期 新辅助治疗 双盲 多中心 CheckMate -274是一项随机、双盲、多中心III期临床研究,旨在评估欧狄沃对比安慰剂 ... 更多
Ⅲ期
双盲
CheckMate-066研究是一项随机双盲III期对照临床试验,共纳入418名患者。所有患者均≥18岁,ECOG评分≤1分,经组织病理确诊为恶性黑色素瘤,且属于无法手术切除的III期及IV期BRAF野生型。所有患者按照1:1随机分配至纳武利尤单抗组和达卡巴嗪组接受治疗。纳武利尤单抗组(最终n=210)患者予以纳武利尤单抗3 mg/kg静脉滴注,每2周为一个治疗周期;对照组(最终n=208)予以达卡巴嗪组1000mg/m2静脉滴注,每3周为一个治疗周期。纳武利尤单抗组和达卡巴嗪组的中位OS分别为37.3个 进入专栏

Ⅲ期 双盲 CheckMate-066研究是一项随机双盲III期对照临床试验,共纳入418名患者。所有患者均 ... 更多
Ⅲ期
新辅助治疗
开放标签
多中心
CheckMate -816是一项随机、开放标签、多中心III期临床试验,旨在评估与单用化疗相比,纳武利尤单抗联合化疗作为新辅助治疗用于可切除IB期至IIIA期非小细胞肺癌患者的疗效(根据第7版AJCC/UICC分期标准),不论患者肿瘤PD-L1表达水平。在主要分析中,358例患者在术前随机接受纳武利尤单抗(360mg)联合基于组织学分型的含铂双药化疗(每3周一个疗程,共3个疗程),或者单用含铂双药化疗(每3周一个疗程,共3个疗程),之后进行手术治疗。研究的主要终点是无事件生存期和病理完全缓解率。次要终点 进入专栏

Ⅲ期 新辅助治疗 开放标签 多中心 CheckMate -816是一项随机、开放标签、多中心III期临床试验,旨在评估与单用化疗相 ... 更多
Ⅲ期
Ⅲ期
双盲
CheckMate 577是一项全球、随机、双盲、安慰剂对照的3期临床试验。接受过新辅助放化疗、手术切除(R0)的II-III期食管癌或GEJ癌症,且仍有残留病理疾病的患者,2:1随机分组接受纳武利尤单抗(前16周每2周240 mg,后续每4周480 mg)或安慰剂治疗。试验干预的最长期限为1年。主要终点是无病生存期。 中位随访时间为24.4个月。在532例接受纳武利尤单抗的患者中,中位无病生存时间为22.4个月;在262例接受安慰剂的患者中,中位无病生存时间为11.0个月。纳武利尤单抗降低疾病复发或死 进入专栏

Ⅲ期 Ⅲ期 双盲 CheckMate 577是一项全球、随机、双盲、安慰剂对照的3期临床试验。接受过新辅助放 ... 更多
Ⅱ期
新辅助治疗
一项Ⅱ期研究,评估了新辅助纳武利尤单抗或纳武利尤单抗+伊匹木单抗治疗 NSCLC。包括44例可手术NSCLC患者,新辅助药物纳武利尤单抗或纳武利尤单抗 +伊匹木单抗。并采用主要病理反应(MPR)作为主要终点。结论:纳武利尤单抗+伊匹单抗在新辅助治疗在可切除NSCLC患者中疗效优于纳武利尤单抗单药治疗。患者术前接受3个周期的新辅助治疗,治疗后第3~6周内进行手术。结果显示MPR率为单药组22%(5/23)vs 联合组38%(8/21),pCR(单药组9% vs联合组29%)。影像学评价单药组ORR为22%, 进入专栏

Ⅱ期 新辅助治疗 一项Ⅱ期研究,评估了新辅助纳武利尤单抗或纳武利尤单抗+伊匹木单抗治疗 NSCLC。包 ... 更多
Ⅲ期
多中心
CheckMate-743是一项全球多中心、随机、对照的III期临床研究,共纳入605例既往未经治疗的、不可切除恶性胸膜间皮瘤患者,一线接受纳武利尤单抗联合伊匹木单抗(双免疫治疗组,n=303)或培美曲塞联合顺铂/卡铂 (化疗组,n=302)治疗。研究结果显示,最短随访22个月时,在总人群中双免疫治疗组患者的中位OS较化疗组显著提高了4个月(18.1个月vs.14.1个月; HR: 0.74 ;96.6% CI: 0.60, 0.91; p=0.002)。双免疫治疗组患者2年生存率为41%,化疗组为27% 进入专栏

Ⅲ期 多中心 CheckMate-743是一项全球多中心、随机、对照的III期临床研究,共纳入605例既往未经 ... 更多
Ⅲ期
多中心
CHECKMATE -078是一项多中心、随机III期研究,比较了O药与多西他赛在含铂双药化疗治疗后出现疾病进展的IIIb/IV期非小细胞肺癌(NSCLC)患者中的疗效与安全性。该研究主要在中国进行,在中国香港、俄罗斯和新加坡同时设有研究中心。该试验共入组504名鳞状和非鳞NSCLC患者(451名来自中国,45名来自俄罗斯,8名来自新加坡),包括PD-L1表达水平<1% 和≥1%的患者,随机分组分别给予每2周1次静脉注射O药 3 mg/kg(n=338),或每3周1次静脉注射多西他赛75 mg/m2(n= 进入专栏

Ⅲ期 多中心 CHECKMATE -078是一项多中心、随机III期研究,比较了O药与多西他赛在含铂双药化疗治 ... 更多
Ⅲ期
多中心
CheckMate 459是一项随机、多中心的临床Ⅲ期研究,纳入743例18岁或18岁以上未接受系统治疗的晚期肝癌患者。1:1随机分组后,371例患者每2周接受静脉注射240 mg纳武利尤单抗,372例患者每天两次口服400 mg索拉非尼。纳武利尤单抗组中位OS为16.4个月,索拉非尼组为14.7个月(P =0.0752);纳武利尤单抗组12个月OS发生率为59.7%,索拉非尼组为55.1%;24个月的OS发生率分别为36.8%和33.1%。纳武利尤单抗和索拉非尼治疗组中位无进展生存期(PFS)相似,分别 进入专栏

Ⅲ期 多中心 CheckMate 459是一项随机、多中心的临床Ⅲ期研究,纳入743例18岁或18岁以上未接受系 ... 更多
Ⅲ期
双盲
一项双盲III期试验,评估了纳武利尤联合伊匹单抗和纳武利尤单药治疗作为ED-SCLC一线化疗后的维持治疗的疗效差异。将834名参与者随机分配(1:1:1)至联合用药组或单药治疗组。前者为纳武利尤 1 mg/kg加伊匹3 mg/kg,每3周1次,持续12周,随后纳武利尤 240 mg每2周1次给药;后者为仅用纳武利尤240 mg每2周1次或安慰剂持续≤2年或直至进展或不可接受的毒性治疗。总的来说,与安慰剂相比,纳武利尤联合伊匹单抗治疗组患者OS没有显著延长。同时,纳武利尤单药组OS中位为10.4个月,也没有 进入专栏

Ⅲ期 双盲 一项双盲III期试验,评估了纳武利尤联合伊匹单抗和纳武利尤单药治疗作为ED-SCLC一线 ... 更多
Ⅱ期
研究计划入组30名患者,入组条件包括:年龄>18岁,ECOG 0-1,CD30+>1%, auto-HCT(自体移植)后复发/难治,不适合自体造血干细胞移植患者需接受2线及以上多药化疗方案。 研究分为两个阶段:I期为剂量评估(未出现剂量-毒性反应),II期采用I期剂量,评估安全性和疗效。 治疗方案:Nivo 240mg联合BV 1.8mg/kg(最大剂量为180mg)每三周一次。 所有患者于治疗前、开始用药后第6周、第12周接受PET-CT评估,随后每9周评估1次(共4次);治疗1年后每 进入专栏

Ⅱ期 研究计划入组30名患者,入组条件包括:年龄>18岁,ECOG 0-1,CD30+>1%, auto-HCT(自体移植) ... 更多
Ⅱ期
多中心
CheckMate 142研究是一个多中心,开放的临床II期研究。在全球8个国家,28个研究中心招募入组ipilimumab联合nivolumab治疗队列的患者。该研究入组119例既往接受过系统性的氟尿嘧啶+奥沙利铂或伊立替康治疗的复发性CRC或转移性CRC患者,同时经检测确认患者为dMMR和/MSI-H型。入组患者接受nivolumab 3mg/kg +ipilimumab 1mg/kg,q3w,4个周期治疗后序贯nivolumab 3mg/kg,q2w治疗直至疾病进展、或因不良事件停药、死亡以及患者要 进入专栏

Ⅱ期 多中心 CheckMate 142研究是一个多中心,开放的临床II期研究。在全球8个国家,28个研究中心招 ... 更多
Ⅲ期
一线治疗
开放标签
CheckMate-9DW是一项随机、开放标签、III期临床研究,评估了与研究者选择的索拉非尼/仑伐替尼治疗方案相比,opdivo联合Yervoy一线治疗未接受过系统治疗的晚期HCC患者的疗效与安全性。 约668例晚期HCC患者被随机分组,分别接受纳opdivo联合Yervoy(Opdivo 1mg/kg+Yervoy 3mg/kg Q3W,最多4个周期,序贯Opdivo单药480mg Q4W)静脉输注或索拉非尼/仑伐替尼治疗。研究的主要终点为总生存期(OS),关键次要终点包括客观缓解率(ORR)和至症状 进入专栏

Ⅲ期 一线治疗 开放标签 CheckMate-9DW是一项随机、开放标签、III期临床研究,评估了与研究者选择的索拉非尼 ... 更多